Lectura – Enzimas: los maestros de la transformación biológica
¿Qué requiere una enzima para ser efectiva?
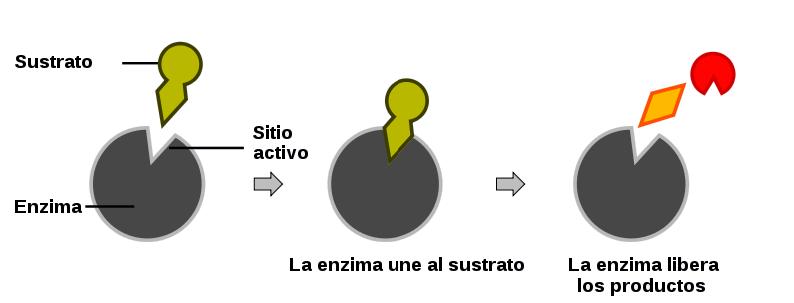
Complejo Enzima-Sustrato
Las enzimas funcionan mediante la formación de un complejo temporal con sus sustratos, conocido como el complejo enzima-sustrato (E-S). Este proceso sigue los siguientes pasos:
- Unión: El sustrato se une al sitio activo de la enzima, una región específica donde ocurre la reacción.
- Formación del complejo: Se forma el complejo enzima-sustrato, estabilizado por enlaces no covalentes como puentes de hidrógeno, fuerzas de Van der Waals y enlaces iónicos.
- Conversión: La enzima cataliza la conversión del sustrato en productos.
- Liberación: Los productos se liberan, y la enzima queda libre para catalizar otra reacción.
Especificidad de las enzimas
La especificidad enzimática hace referencia a la capacidad de una enzima para seleccionar y actuar sobre un sustrato específico entre muchos otros compuestos. Esta especificidad depende de la estructura tridimensional del sitio activo de la enzima, que es complementaria a la del sustrato, un ejemplo a la vida cotidiana es una llave (sustrato) y una cerradura (enzima). Algunas enzimas requieren la presencia de moléculas no proteicas, llamadas cofactores, para funcionar correctamente. Los cofactores pueden ser:
- Iones metálicos: Como el magnesio, el zinc y el hierro, que estabilizan la estructura enzimática o participan directamente en la catálisis.
- Moléculas orgánicas: Llamadas coenzimas, como el NAD+ y el FAD, que actúan como transportadores temporales de grupos químicos. Muchas coenzimas derivan de vitaminas.
Condiciones optimas

La actividad enzimática depende de diversas condiciones ambientales. Las condiciones óptimas son aquellas en las que la enzima muestra su máxima actividad. Estas incluyen:
- Cada enzima tiene un pH óptimo: la pepsina, una enzima digestiva en el estómago, tiene un pH óptimo alrededor de 2. Mientras que la tripsina, en el intestino delgado, tiene un pH óptimo de aproximadamente 8.
- La actividad enzimática aumenta con la temperatura hasta un punto óptimo: más allá del cual la enzima se desnaturaliza y pierde su función. Para muchas enzimas humanas, la temperatura óptima es alrededor de 36.5 y 37°C (temperatura corporal normal).
- Concentración de sustrato: Hasta un cierto punto, aumentar la concentración de sustrato incrementa la tasa de reacción enzimática. Una vez que la enzima está saturada, la tasa de reacción se nivela.
- Presencia de inhibidores o activadores: Las moléculas que inhiben o activan la actividad enzimática pueden alterar las condiciones óptimas.
¿Qué ocurre con las proteínas de nuestro cuerpo cuando tenemos fiebre?
La fiebre es una respuesta fisiológica del cuerpo a infecciones, inflamaciones u otras condiciones médicas. Cuando tenemos fiebre, la temperatura corporal se eleva por encima de lo normal. Este aumento de temperatura puede tener varios efectos sobre las proteínas en nuestro cuerpo:
1. Desnaturalización de proteínas: Las proteínas son moléculas sensibles a los cambios de temperatura. La fiebre puede causar que algunas proteínas se desnaturalicen, es decir, pierdan su estructura tridimensional y, por lo tanto, su función. La desnaturalización ocurre porque los enlaces no covalentes que mantienen la estructura de la proteína (como los puentes de hidrógeno, las interacciones hidrofóbicas y las fuerzas de Van der Waals) se rompen a temperaturas elevadas. Como podemos observar en la siguientes grafica, con forme aumenta la temperatura optima la proteína empieza a desnaturalizarse.

2. Proteínas de choque térmico (HSP): En respuesta al estrés térmico, como la fiebre, las células aumentan la producción de proteínas de choque térmico (HSP). Las HSP son una clase de proteínas que ayudan a estabilizar y refoldar proteínas desnaturalizadas, evitando su agregación y facilitando su correcta conformación. Actúan como chaperonas moleculares, asegurando que las proteínas mantengan su funcionalidad a pesar del estrés térmico.
3. Enzimas y metabolismo: Las enzimas, que son proteínas catalizadoras, tienen una temperatura óptima para su actividad. Cuando la temperatura corporal se eleva debido a la fiebre, la actividad enzimática puede aumentar inicialmente, pero si la temperatura se vuelve demasiado alta, las enzimas pueden desnaturalizarse y perder su función. Esto puede afectar diversas rutas metabólicas y procesos bioquímicos en el cuerpo.
4. Función del sistema inmunológico: La fiebre también tiene un papel en la respuesta inmunológica. La temperatura elevada puede inhibir el crecimiento de ciertos patógenos (bacterias y virus) y mejorar la eficiencia de las células inmunitarias, como los linfocitos y los macrófagos. Estas células pueden funcionar de manera más efectiva a temperaturas ligeramente elevadas, mejorando la respuesta del cuerpo a las infecciones.
5. Síntesis de proteínas: El estrés térmico debido a la fiebre puede afectar la síntesis de proteínas. El cuerpo puede priorizar la producción de proteínas esenciales y las HSP mientras reduce la síntesis de otras proteínas no esenciales. Esto asegura que las células dispongan de los recursos necesarios para enfrentarse al estrés y mantener las funciones vitales.
